原子半径在周期表中呈现规律除第一周期外,其他周期元素不包括惰性气体的半径随着原子序数增加而减小同一族的元素从上到下,随着电子层数的增加,原子半径逐渐增大元素的化合价有明显变化同周期从左到右,金属元素的最高正价从碱金属的+1逐渐升至+7,非金属的负价从碳族的4递增至1氟无正价,氧无+6价同一主族,元;1 碱金属元素从上到下,原子半径逐渐增大2 随着原子半径的增大,熔沸点逐渐降低3 金属性随着原子序数的增加而增强4 非金属性则随着原子序数的增加而减小5 失电子能力从上到下逐渐增大6 得电子能力从上到下逐渐减小7 还原性随着原子序数的增加而增大8 氧化性随着原子序数的。
1除第1周期外,其他周期元素惰性气体元素除外的原子半径随原子序数的递增而减小2同一族的元素从上到下,随电子层数增多,原子半径增大2 元素化合价 1除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族4递增到1氟无正价,氧无+6;原子半径除第一周期外,其他周期元素的原子半径随原子序数的增加而减小同一族的元素从上到下,随电子层数增多,原子半径增大元素化合价除第一周期外,同周期元素从左到右,元素最高正价由碱金属递增到+7,非金属元素负价由碳族4递增到1同一主族元素的最高正价负价均相同单质的熔点。
原子半径随原子序数递增而减小,除第一周期外,其他周期的元素除了惰性气体遵循这一规律在相同族的元素中,从上到下原子半径增大,这是电子层数增多的结果元素的化合价表现出不同的模式在同周期中,从左到右,元素最高正价由碱金属的+1递增至+7,而非金属元素负价由碳族的4递增至1;在元素周期表中,同一纵组的元素原子半径自上而下依次递增这是由于随着原子序数的增加,电子壳层数逐渐增多,导致原子半径增大三碱金属元素原子半径的比较 根据元素周期表中原子半径的变化规律,我们可以推断出碱金属元素中原子半径的大小顺序在这个顺序中,锂的原子半径最小,而钫的原子半径最大。
元素周期表中的元素及其化合物展现出一系列递变性规律以原子半径为例,除了第一周期外,其他周期元素除惰性气体元素外的原子半径会随原子序数增加而减小在同一族中,元素从上往下,随着电子层数的增加,原子半径会增大元素的化合价也呈现出规律性变化在除第一周期外的同周期元素中,从左到右;1 原子半径的递变性 在元素周期表中,除第1周期外,其他周期的元素除去惰性气体的原子半径随着原子序数的增加而减小 同族元素从上到下,随着电子层数的增加,原子半径增大2 元素化合价的递变性 同周期元素从左到右,最高正价从碱金属的+1递增至+7,非金属元素的负价从碳族的4。
1 原子半径规律 除第一周期外,其余周期元素随着原子序数递增,原子半径逐渐缩小 同一族元素从上到下,电子层数增加,原子半径增大2 化合价规律 金属元素的正价从碱金属的+1逐渐升至+7,非金属则从碳族的4升至1 主族元素的正负价,从上至下保持一致3 熔点规律 金属元素随着原子序数。
碱金属元素的原子半径随着原子序数的增加而减小吗
1 原子半径除了第一周期,其他周期的元素稀有气体元素除外的原子半径随着原子序数的增加而减小同一族的元素从上到下,随着电子层数的增加,原子半径增大第五和第六周期的副族元素除外2 元素化合价除了第一周期,同周期元素从左到右,第二周期的元素最高正价从碱金属的+1递增到氮。
元素周期表中原子半径跟元素序数的关系1主族元素同主族的,从上到下,半径逐渐变大因为电子层数在不断增加2同周期的,从左到右,半径逐渐变小因为质子数增加吸引力越大,半径随之减少3副族元素半径变化没有规律附主族元素原子半径图。
1 密度变化碱金属的密度随着原子序数的增加总体上呈现减小的趋势,但钾元素出现了密度反常现象这是因为虽然相对原子质量的增加会导致密度的增大,但原子体积的增大对密度的影响更为显著,导致钾的密度反而低于钠2 熔沸点趋势碱金属的熔点和沸点随着原子序数的增加而逐渐降低3 化学反应活性。

因为金属融化破坏的是金属键,而随原子序数增加半径增加所以金属键越弱碱金属元素随着核电荷数的增加,原子半径逐渐增大,从上到下活泼性强的金属氢氧化物能电离出更多的氢氧根离子,单质熔点出现下降趋势,化学性质越来越活泼或者说金属性越来越强,氢氧根离子的数量越多,金属性逐渐增强,但物理性质;其他周期元素惰性气体元素除外的原子半径随原子序数的递增而减小同一族的元素从上到下,随着电子层数增多,原子的半径也会随之增大元素化合价的规律除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族4递增到1氟无正价,氧无+6价,除外。
同一主族随核电荷数的递增,原子半径逐渐增大例如第IA族HltLiltNaltKltRbltCsltFr化学元素周期表是根据原子序数从小至大排序的化学元素列表列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如碱金属元素碱土金属卤族元素稀有气体等这使周期表中形成元素分区;碱金属的氧化性规律 随着原子序数的增加从上到下,碱金属的还原性增强,氧化性减弱这是因为电子层数增加导致原子半径扩大,从而减弱了原子核对最外层电子的吸引力,使得金属原子更容易失去电子,表现出更强的还原性卤素的氧化性规律 随着原子序数的增加从上到下,卤素的氧化性减弱。

原子半径除第一周期外,随着原子序数的递增,其他周期元素的原子半径通常减小同一族内,自上而下,电子层数增加,原子半径相应增大元素化合价除第一周期外,同周期自左至右,金属元素最高正价由碱金属的+1逐渐升至+7,非金属元素负价从碳族的4递增至1同一主族中,元素的最高正价和负价。


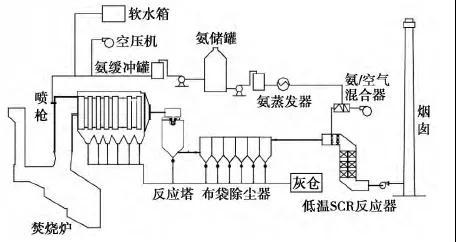




添加新评论