1 碱金属元素从上到下,金属性依次增强2 单质的还原性也随着原子序数的增加而增强3 碱金属单质与氧气反应的产物随着原子序数的增加而变得更加复杂4 反应程度也随之增加,反应更加剧烈5 从上到下,碱金属单质的密度逐渐增大,但钾元素出现反常6 金属键强度从上到下逐渐减弱,导致熔点。
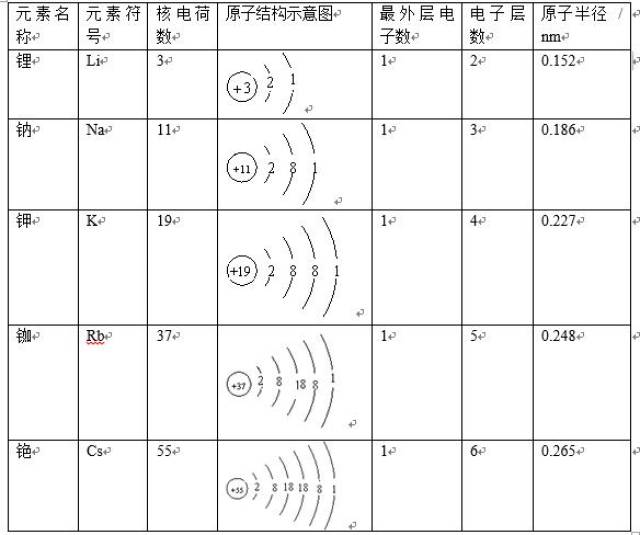
结构异同点 1相同点最外电子层上都只有1个电子2递变规律从锂到铯核电荷数增大,电子层数增多,原子半径增大失电子能力增强,还原性增强碱金属元素有原子结构上有一定的相似性和递变性,而结构决定性质,它们在性质上存在相似性和递变性。

2 由于最外层电子数减少,碱金属元素从上到下,在化学反应中更容易失去电子3 随着原子序数的增加,碱金属元素的原子量也逐渐增大,但这并不是导致其化学性质变化的主要因素4 从上到下,碱金属元素的离子半径逐渐增大,这也影响了其化学性质,使其更容易失去电子5 碱金属元素从上到下。
1相似性最外层电子数为1 2递变性1电子层数逐渐增多2熔点逐渐降低3沸点逐渐降低4密度呈增大趋势但NAK5金属性逐渐增强3碱金属元素的主要化学性质1与氧气反应都可以与氧气反应,但Li的燃烧产物为普通氧化物Li2O,而Na的燃烧产物为过氧化物Na2O2,K,Rb,Cs的燃烧。
碱金属元素从上到下递变规律如下碱金属元素,金属性从上到下依次增加,单质还原性依次增强,单质与O2反应的产物越来越复杂,反应程度越来越剧烈,碱金属元素,从上到下,单质的密度逐渐增大,钾反常,金属键从上到下依次减弱,所以熔沸点逐渐降低。
第七主族的卤素,其单质是分子晶体,故熔沸点由分子间作用力决定,在分子构成相似的情况下,相对分子质量越大,分子间作用力也越大,所以卤素的熔沸点递变规律是从上到下熔沸点依次升高位置关系一元素化合价 1除第1周期外,同周期从左到右,第二周期元素最高正价由碱金属+1递增到氮元素。








添加新评论