1、碱金属元素从上到下递变规律如下碱金属元素,金属性从上到下依次增加,单质还原性依次增强,单质与O2反应的产物越来越复杂,反应程度越来越剧烈,碱金属元素,从上到下,单质的密度逐渐增大,钾反常,金属键从上到下依次减弱,所以熔沸点逐渐降低。
2、1同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减2同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增第一主族的碱金属熔沸点是由金属键键能决定,在所带电荷相同的情况下,原子半径越小,金属键键能越大,所以碱金属的熔沸点递变规律。
3、总的来说,碱金属元素从上到下递变时,原子半径增大,电离能降低,电负性降低,金属性增强,熔点和沸点降低,反应性增强。
4、卤族元素的熔沸点变化规律是碱金属的熔沸点从上到下逐渐降低,卤素单质的熔沸点从上到下逐渐升高金属晶体熔点看金属键的强弱,金属离子半径越小所带电荷越多金属键越强,熔点就越高卤素分子晶体看分子间作用力的强弱,对组成和结构相似的物质,相对分子质量大,分子间作用力强熔点就越高卤素熔沸点。
5、1 碱金属一族的熔沸点在这一列元素中随原子序数的增加而降低2 这可以通过元素周期表的排列规律得到解释,因为在这一族元素中,原子结构中的最外层电子数相等,核电荷数逐渐增加,原子半径逐渐缩小,电子云被吸得更紧,因此元素的电负性逐渐增强,金属元素的性质变得更加活泼,相似价电子云层向外扩张。
6、单质的熔点1同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,而非金属单质的熔点递减2同一族元素从上到下,金属单质的熔点递减,而非金属单质的熔点递增化学元素周期列表化学元素周期表是根据原子序数从小至大排序的化学元素列表列表大体呈长方形,某些元素周期中留有空格,使特性相近。
7、碱金属的密度变化规律碱金属的密度变化规律是随核电荷数的增大而增大,从上往下金属性增强,单质还原性增强,熔沸点降低,密度增大元素金属性强的的单质还原性强,阳离子氧化性弱,元素非金属性强的则相反钾的密度比钠的密度小对钾来说,核对最外层引力较小,体积增大的效应大于相对原子质量增加。
8、2 从锂到铯,单质的还原性逐渐增强3 碱金属单质与氧气反应的产物从锂氧化物到铯过氧化物,逐渐变得更加复杂4 反应程度随着原子序数的增加而变得更加剧烈5 碱金属元素的单质密度从锂到铯逐渐增大,但钾的密度异常6 金属键强度从锂到铯依次减弱,导致熔点和沸点逐渐降低。
9、碱金属属于金属晶体,从金属键的角度考虑从上往下,金属阳离子半径增大,对外层电子束缚能力减弱,金属键减弱熔沸点降低 卤素属于分子晶体,考虑范德华力 从上往下,分子的相对分子质量增大,范德华力增强,熔沸点升高。
10、1 碱金属的密度递变规律 碱金属的密度随着原子序数的增加总体上呈现增大的趋势然而,在从钠到钾的过程中,出现了密度反常的现象这是因为虽然相对原子质量的增加会导致密度的增大,但原子体积的增大对密度的贡献更大,导致钾的密度反而小于钠2 碱金属的熔沸点递变规律 碱金属的熔点和沸点随着。
11、在元素周期表中,元素的熔点特性遵循一定的规律1 在同一周期内,随着原子序数的增加,金属元素的熔点通常会升高,而非金属元素的熔点则会降低2 在同一族中,从上到下,金属元素的熔点往往会降低,而非金属元素的熔点则会升高举例来说,第一主族的碱金属,其熔沸点主要由金属键的键能决定在。
12、碱金属的密度变化规律是随核电荷数的增大而增大,从上往下金属性增强,单质还原性增强,熔沸点降低,密度增大元素金属性强的的单质还原性强,阳离子氧化性弱,元素非金属性强的则相反但是有个特例,钾的密度比钠的密度小对钾来说,核对最外层引力较小,体积增大的效应大于相对原子质量增加产生的。
13、整体趋势碱金属元素的熔点普遍较低随原子序数变化从锂到铯,随着原子序数的增加,碱金属的熔点逐渐降低这意味着锂的熔点相对较高,而铯的熔点则非常低物理性质体现由于碱金属的熔点低,当它们与水反应时,由于反应放热,碱金属大多会迅速熔化成小球状这一规律反映了碱金属元素在物理性质上。
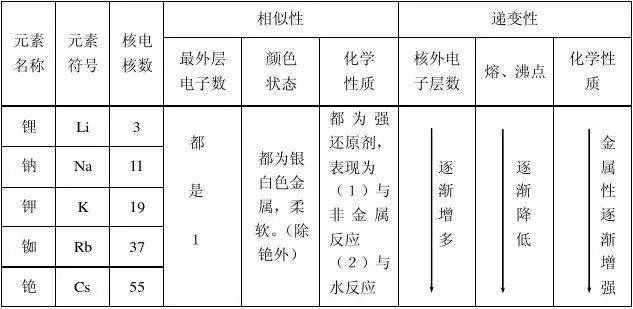
14、1 碱金属的物理性质相似性 颜色通常为银白色,铯略带金色 硬度普遍较小 密度相对较低 熔点较低 导热性和导电性良好2 碱金属的递变规律 从锂到铯,密度总体呈减小趋势但钾有反常现象 熔点和沸点逐渐降低关于密度的递变规律,通常认为随着原子序数的。
15、碱金属的密度变化规律是随核电荷数的增大而增大,从上往下金属性增强,单质还原性增强,熔沸点降低,密度增大元素金属性强的的单质还原性强,阳离子氧化性弱,元素非金属性强的则相反钾的密度比钠的密度小对钾来说,核对最外层引力较小,体积增大的效应大于相对原子质量增加产生的影响,结果钾的。
16、根据原子半径大小及其稳定性决定其对应单质的稳定性,从而比较熔点1 同一周期,从左到右看,原子还原性得电子能力减弱,氧化性失电子能力增强,因为原子半径减小,原子越来越稳定,即氧化性增强因此,同一周期,从左到右,元素单质的熔点逐渐减小总体一般性2·3 同一主族,从上到下。
17、1同一周期的元素随着原子序数的递增,元素所构成的金属单质的熔点逐渐递增,非金属单质的熔点逐渐递减副族熔点在VIB族达到最高,以后依次递减2同一主族的元素从上到下,元素所构成的金属单质的熔点逐渐递减,非金属单质的熔点递增副族不规则3对于晶体类型不同的物质,一般来讲。
18、化学特性揭示的秘密 碱金属和碱土金属的氧化物性质差异显著碱金属氧化物熔点低,易于水解生成碱,如钠与水反应产生氢气而碱土金属氧化物熔点高,难溶于水此外,碱金属易于形成复杂的氧化物,如过氧化物和臭氧化物,而碱土金属在这方面相对较弱在盐类性质上,碱金属盐普遍可溶于水,而碱土金属。








添加新评论