然后利用实验事实验证推测的正确性,这样的学习顺序是对学生科学的学习方法和学习态度的培养教材在重点介绍了钠的有关知识之后,由个别到一般,进一步归纳出碱金属性质的相似性与递变性,以及与核外电子排布的关系,从知识基础科学方法等方面为介绍元素周期律和元素周期表等打基础,使将来元素周期律的引出能够做到“水到。
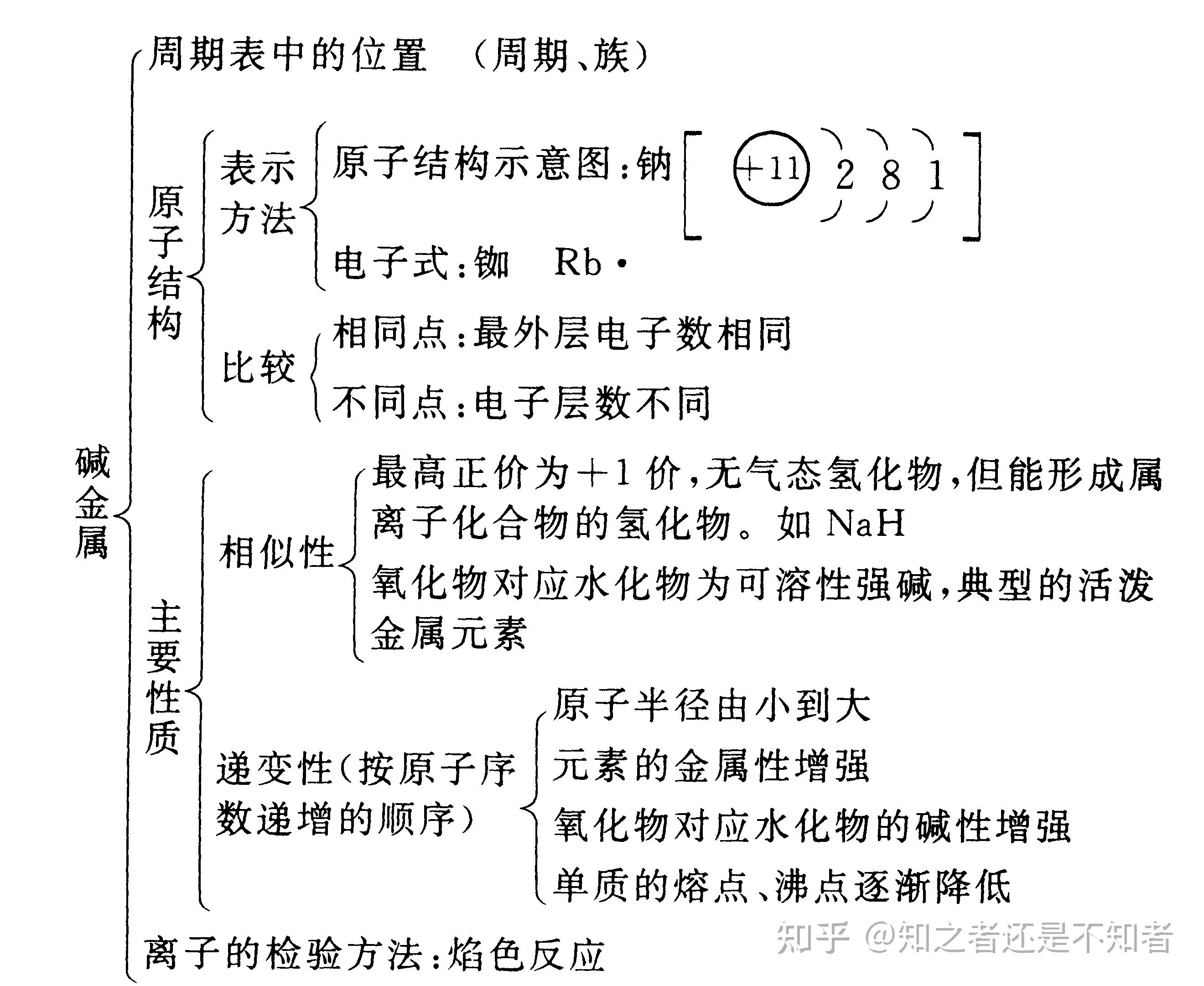
碱金属元素的性质 一原子结构 1 共同点最外层电子数都是1,易失电子,具有较强的还原性 2 不同点电子层数增加,原子半径增大失电子能力逐渐增强,还原性增强 二单质的物理性质 1 共同点*都有银白色的金属光泽,质软,密度小,熔点低,有较好的导电导热。
过渡金属的原子结构特点 与主族元素相比,过渡金属的原子结构具有两个特点,一是原子的Z外层电子不超过2个多数是2,少数是1,二是过渡金属原子的次外层或者倒数第3层的电子未充满,属于不稳定结构同一纵行列中,元素原子的结构特点有类似于主族的相似性和递变性过渡金属的性质特点 1过渡金属。

元素周期表中元素及其化合物的递变性规律 1 原子半径 1除第1周期外,其他周期元素惰性气体元素除外的原子半径随原子序数的递增而减小2同一族的元素从上到下,随电子层数增多,原子半径增大注意原子半径在VIB族及此后各副族元素中出现反常现象从钛至锆,其原子半径合乎规律地增加。








添加新评论